Cofepris
Medicamentos inseguros: falla la vigilancia de Cofepris (Video)
Con los consecuentes riesgos a la salud que esto implica, la Cofepris falla al detectar los avisos de reacciones adversas de medicamentos, entre otras causas por la opacidad (inexistencia o insuficiencia de datos), falta de notificación, mal registro y conflictos de interés entre prescriptores.Con los consecuentes riesgos a la salud que esto implica, la Cofepris falla al detectar los avisos de reacciones adversas de medicamentos, entre otras causas por la opacidad (inexistencia o insuficiencia de datos), falta de notificación, mal registro y conflictos de interés entre prescriptores, dispensadores e industria de los medicamentos. Por si fuera poco, se detectó que personal ajeno al órgano regulador sesgó los datos de la plataforma de farmacovigilancia de la comisión.
CIUDAD DE MÉXICO (Proceso).– En México existe una deficiente detección de riesgos en la seguridad de los medicamentos que la población consume. En la última década, en la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), la farmacovigilancia no ha cumplido con la regulación y presenta fallas a la seguridad por la intromisión de empresas farmacéuticas. Así, la determinación de las alertas sanitarias y la cancelación de fármacos suceden a solicitud de iniciativas privadas y no por acciones de la farmacovigilancia gubernamental.
Laboratorios Pisa, SA de CV, y Propharma Research Organization, SA de CV, son dos de las empresas que vulneraron la plataforma digital Notireporta, un sistema de cómputo que, de julio de 2017 a septiembre de 2019, se utilizó para captar los avisos de sospecha de reacciones adversas a los medicamentos (RAM) que la población, personal médico y farmacéuticas enviaron a la Cofepris. La información de los avisos es la base de la farmacovigilancia nacional, ya que de ésta se evalúa el factor riesgo-beneficio de los fármacos.
Durante la operación de Notireporta, únicamente debió tener acceso al sistema el personal de farmacovigilancia de la Cofepris, pero no fue así. Usuarios ajenos al órgano regulador pudieron acceder y sesgar la información captada de cerca de 100 mil notificaciones, 18.7% de los registros. Son 533 mil 135 notificaciones contenidas en tres plataformas de 2001 a 2021: Access, Notireporta y Vigiflow.
Sin embargo, la información de los registros de RAM almacenada en Notireporta no se ha podido validar porque presenta anomalías que incumplen la NOM-220-SSA1-2016 y causa que la Cofepris no pueda realizar una correcta evaluación de los riesgos en el consumo de los medicamentos disponibles en el mercado. Las fallas: inexistencia o insuficiencia de datos, subnotificación, mal registro, redundancia, incoherencias, falta de motivación de los notificadores, conflictos de intereses entre prescriptores, dispensadores y de la propia industria farmacéutica.
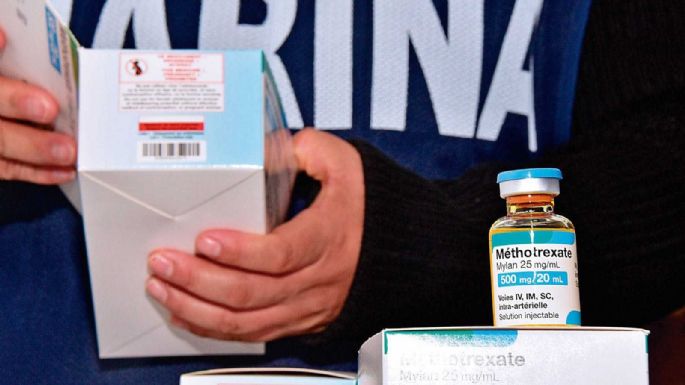
Rosa Itzela, de 19 años, era atendida en 2019 en el Hospital del Niño Poblano (HNP) por cáncer en la sangre, leucemia linfoblástica aguda. El 13 de febrero de ese año ella y otros dos menores, Emir e Iván (de 11 y 16 años) presentaron reacciones adversas neurológicas graves al medicamento durante la quimioterapia con Metotrexato. Dos días después ella murió.
Meses más tarde, en septiembre de 2019, el secretario federal de Salud, Jorge Alcocer Varela, compareció en la Cámara de Diputados y aseguró que las causas de las reacciones adversas en Puebla se debieron a la mala calidad de un lote de Metotrexato. José Antonio Martínez García, su homólogo en aquel estado, corroboró la versión. Pero no brindaron información precisa porque ésta cayó en el vacío y la opacidad de la farmacovigilancia en la Cofepris.
El día de los hechos, Rosario de la Rosa Nava, responsable de las funciones de farmacovigilancia en el HNP, envió a la Cofepris y al laboratorio fabricante, Laboratorios Pisa, SA de CV, los tres avisos alertando de las reacciones adversas que causó el fármaco.
Pero en el Centro Nacional de Farmacovigilancia (CNFV) y en la Comisión de Evidencia y Manejo de Riesgos (CEMAR) esos tres avisos continúan velados y la Cofepris incumple la resolución al recurso de revisión por la información no proporcionada. Ambas instancias son responsables de recibir y analizar la información sobre las sospechas de reacciones adversas a los medicamentos y las vacunas.
La Cofepris niega la existencia de correos electrónicos y otros documentos sobre el evento. Además, los datos de los tres avisos tampoco pueden ser verificados en Notireporta, como se constató en una consulta directa en el CNFV.
No obstante, las copias digitales de los tres avisos de sospecha de RAM y los correspondientes correos electrónicos fueron obtenidos de la Secretaría de Salud de Puebla, mediante recursos de revisión y –para cotejar– también fueron consultados de manera directa en el HNP. Los registros son: 88840, 88813 y 88479.