El marcapasos que le robó la vida a Silvia: las fallas que ponen en riesgo a personas con implantes
En dos décadas, Silvia Álvarez Vega no ha dejado de luchar para poder vivir con un marcapasos que la ha llevado, en incontables ocasiones, a las salas de urgencia médica.
[caption id="attachment_561152" align="alignnone" width="731"] Silvia Álvarez tenía 25 años y estudiaba Arquitectura en la UAM cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. En 1997 le instalaron el primero de tres marcapasos. Foto: Nadia Baram[/caption]
Apenas tenía 25 años, estudiaba Arquitectura en la Universidad Autónoma Metropolitana, cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. El diagnóstico más improbable para una mujer que entrenaba con intensidad para competir en la liga nacional de atletismo.
La única alternativa que le dieron los médicos para poner fin a los recurrentes desmayos era implantarle un marcapasos que estimulara su corazón. La primera vez que entró a quirófano fue el 4 de junio de 1997, en el hospital Siglo XXI de la Ciudad de México.
El día que le instalaron el remedio, comenzó la verdadera pesadilla. Todo está plasmado en un expediente con cientos de páginas. “El marcapasos fue lo que me arruinó porque me la vivía en el hospital”, dijo una tarde de octubre sentada en el comedor de su casa de la colonia Roma, en la Ciudad de México. “Según la situación del marcapasos esa era mi vida. Es una vida robada”, dijo Álvarez, que hoy tiene 49 años y una hija de 19.
El de Silvia Álvarez no es cualquier expediente. “Disfunción de marcapasos” salta a la vista en un certificado médico tras otro. Las anotaciones se refieren a dos de los tres marcapasos que le han implantado en el pecho, el primero en 1997, otro más en 2006 y el último en 2008; el diagnóstico se repite en los reportes de las tres otras ocasiones que los médicos abrieron su pecho para reacomodar un cable que se había desprendido, o para reubicar el generador del marcapasos que se había desplazado de lugar. O la última vez que intentaron, sin éxito, remover los cables de un anterior dispositivo que ya se habían adherido firmemente al corazón, lo que explicaba algunos dolores.
“La paciente ha tenido varias cirugías desde que se implantó por primera vez su marcapasos, todas ellas por disfunción, una por desplazamiento del cable atrial, otras por problemas en la estimulación del marcapaso y otras por la posición del generador”, exhibe un resumen clínico del Hospital General Regional No. 1 de Tijuana, de agosto de 2008.
En suma, su expediente arroja una veintena de diagnósticos, de hospitales públicos y privados, y reportes que dan cuenta del deterioro progresivo de su salud: el dolor persistente, los mareos, los desvanecimientos, las fuertes punzadas en el hombro y en el pecho; la dificultad que llegó a tener para mover siquiera los brazos, además de palpitaciones, arritmias, taquicardias y la pérdida fugaz de la visión.
A la fecha, ningún médico le ha explicado qué ocurrió con sus marcapasos Prodigy, de Medtronic, o el Protos, de Biotronik: si sus males se debían a fallas de los dispositivos, como parecen indicar sus registros, o si su corazón rechazó el implante o los médicos fallaron en la instalación .
“Eso jamás me lo aclararon, en todas las notas aparece ‘disfunción’; nosotros preguntábamos a qué se debía y nos decían que un cable se movió y que el generador cambió de posición”. Y nada más.
Resulta difícil imaginar que un caso como el de Silvia pasara inadvertido después de una procesión de tantos años por tantos hospitales. En su expediente y en la recolección que ella y su esposo Julián Hernández Reyes tienen de ese tiempo, no hay registro de que se hubiera acercado algún ejecutivo de la empresa fabricante, o que alguno de sus médicos buscase respuestas con el fabricante.
Ya desde 1998 había una regulación en México que obligaba a la industria a reportar posibles efectos adversos de sus medicamentos e implantes. Pero fue hasta 2013 que la Comisión Nacional para la Protección Contra Riesgos Sanitarios (Cofepris) quedó a cargo de montar un sistema de vigilancia para recibir y atender los reportes de dispositivos médicos.
Una nueva normativa ordenó que se estableciera en México un sistema similar al que funcionaba, hacía dos décadas, para detectar y prevenir las reacciones adversas a los medicamentos, y que depende de un sistema de reporte de efectos adversos que alimentan pacientes, médicos, hospitales y la industria.
Ese sistema hoy día hace posible que lleguen cada año decenas de alertas a médicos y hospitales alrededor del país. Les llevan novedades acerca del uso de ciertos fármacos, los riesgos o interacciones con otros medicamentos, y en ocasiones anuncian el retiro de productos por problemas de seguridad.
Una investigación de Quinto Elemento Lab, Mexicanos Contra la Corrupción y la Impunidad y Proceso, desarrollada con decenas de entrevistas y cientos de solicitudes de información al gobierno federal y a dependencias en 32 estados, revela que este sistema ha fallado en velar por la seguridad de pacientes como Silvia Álvarez Vega.
Este reportaje es parte del proyecto que lideró el Consorcio Internacional de Periodistas de Investigación (ICIJ por sus siglas en inglés), en el cual trabajaron más de 250 periodistas de 58 medios en 36 países, y que ha puesto al descubierto que las autoridades sanitarias no han logrado proteger a millones de pacientes alrededor del mundo, que resultaron con lesiones provocadas por implantes que debían aliviarlos.
La información obtenida vía Transparencia para el caso de México y los testimonios de pacientes y médicos así lo confirmaron.
El Instituto Mexicano del Seguro Social realiza casi 1.5 millones de cirugías al año, y no ha reportado un solo incidente adverso de 2006 a la fecha, lapso de años de los que se solicitó la información. Lo mismo ocurre con el ISSSTE, otro de los mayores sistemas de salud en el país. Ninguno respondió a las solicitudes de entrevista.
En el Instituto Nacional de Cardiología, el responsable de vigilar fármacos desconocía hace unas semanas si alguien ahí da seguimiento al tema de dispositivos, y en el Instituto Nacional de Pediatría, apenas desde mediados de año tienen a personal para dar seguimiento a posibles reportes.
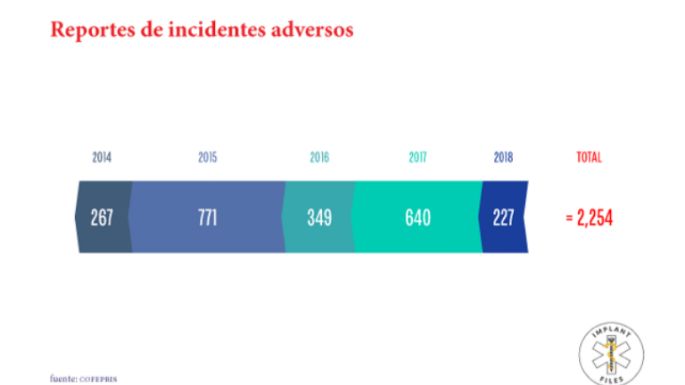
Según la Cofepris, de 2013 a la fecha han llegado a sus manos dos mil 254 reportes de incidentes adversos ocasionados por dispositivos en diversas regiones del país.
Una diferencia considerable, si se compara con los 5.4 millones de reportes que enviaron los fabricantes, médicos, abogados y pacientes en la última década, a la agencia del gobierno estadounidense a cargo de la vigilancia, la Food and Drug Administration (FDA), y que fueron analizados por ICIJ. Estos reportes a la FDA están relacionados con 1.7 millones de lesiones y 83 mil muertes de personas.
Lo que la investigación también encontró es que en EU hubo 26 mil 700 retiros de dispositivos en la última década y ocho mil 300 en Canadá. México, que es uno de los más grandes mercados de dispositivos en América Latina, sólo reportó dos y ambos productos eran de bajo riesgo. El primero fue una cánula –un delgado tubo que se introduce en una incisión en la piel del paciente para explorar sus articulaciones- y el otro fue un tubo de gel lubricante sexual.
La vigilancia de los dispositivos médicos es importante por tratarse de equipos que se implantan dentro del cuerpo y porque, según reveló la investigacIón internacional de ICIJ, los gobiernos imponen estándares de seguridad más bajos a los implantes médicos que a las medicinas. (https://goo.gl/r59vtW)
Es también pertinente por el gran empuje que tienen la industria y su brazo comercial. Solo en México hay casi 40,000 productos autorizados y la colección crece en 2,500 permisos por año.
Una industria crece
El gobierno considera a éste un sector estratégico. Las más grandes empresas del mundo tienen fábricas aquí, sobre todo en Tijuana y el corredor de la frontera norte; México ya aparece en el lugar ocho entre los exportadores de dispositivos más grandes en el mundo.
No solo eso. México es un importante mercado para sus productos -les dio ventas por nueve mil 568 mdd en 2017 y crecerá en los próximos años, indican análisis del mercado. Una gran porción de la población de México está entrando a la edad adulta; los mayores de 50 años están siempre entre los mejores clientes de este sector que desarrolla, fabrica y vende prótesis de columna para aliviar el dolor de personas con vértebras dañadas; stents que puestos en las arterias han salvado la vida a millones de personas con cardiopatías.
Sin embargo, según las fuentes consultadas, el gobierno federal ha puesto más atención en ayudar a la industria a crecer que en desarrollar un aparato robusto que vigile la seguridad de los dispositivos que están siendo utilizados.
Cofepris presumió hace unos meses que logró dar trámite a más de 19,000 solicitudes de permiso en un tiempo récord de tres a 15 días, cuando es algo que suele resolver en meses.
En contraste, la plataforma que abrió en internet para recibir reportes de los médicos y ciudadanos lleva casi un año caída; funciona con intermitencias desde el terremoto de 2017.
El área que da seguimiento a los dispositivos médicos tenía seis integrantes en 2013 -
tres ingenieros, una química y dos pasantes-. Para 2015, el equipo había sumado un integrante más, según Lorena Garza de Allende, primera encargada del departamento.
De acuerdo con las fuentes consultadas, este pequeño equipo de Cofepris tiene a su cargo una tarea descomunal. Deben revisar el informe que cada cinco años entregan las empresas para renovar su permiso, y que contiene información sobre los incidentes adversos que se suscitaron y las medidas de seguridad que tomó, dijo Garza, actual vicepresidenta del Colegio de Ingenieros Biomédicos de México.
Los técnicos deben entrenar a médicos alrededor del país para que aprendan a identificar y a reportar un posible incidente adverso y dar a conocer entre pacientes que, también ellos, tienen derecho a reportar y cómo hacerlo. Además les toca atender los reportes de incidentes adversos y asegurarse que la industria investigue. Porque, según la norma mexicana que regula a los dispositivos, son las empresas las que deben investigar.
A contrapelo de la política de la FDA y de otras agencias alrededor del mundo, que hacen pública la información de los reportes y la hacen circular al público, a la comunidad médica y la industria, la Cofepris mantiene la información reservada.
Según datos oficiales, en los últimos cinco años, la industria investigó 55 casos de incidentes graves en pacientes en México, pero la Cofepris negó revelar los detalles. Reservó el nombre del dispositivo, la marca y el modelo y los daños que provocó. Esa es información que sí publican los órganos de vigilancia de otros países.
“En caso de que se diera a conocer la información contenida en los expedientes de tecnovigilancia, la población podría suponer que un determinado dispositivo médico produce determinados incidentes adversos cuando no es así”, respondió la Cofepris a las solicitudes de información. La dependencia no atendió a repetidas solicitudes de entrevista hechas en el último mes.
Silvia Álvarez tenía 25 años y estudiaba Arquitectura en la UAM cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. En 1997 le instalaron el primero de tres marcapasos. Foto: Nadia Baram[/caption]
Apenas tenía 25 años, estudiaba Arquitectura en la Universidad Autónoma Metropolitana, cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. El diagnóstico más improbable para una mujer que entrenaba con intensidad para competir en la liga nacional de atletismo.
La única alternativa que le dieron los médicos para poner fin a los recurrentes desmayos era implantarle un marcapasos que estimulara su corazón. La primera vez que entró a quirófano fue el 4 de junio de 1997, en el hospital Siglo XXI de la Ciudad de México.
El día que le instalaron el remedio, comenzó la verdadera pesadilla. Todo está plasmado en un expediente con cientos de páginas. “El marcapasos fue lo que me arruinó porque me la vivía en el hospital”, dijo una tarde de octubre sentada en el comedor de su casa de la colonia Roma, en la Ciudad de México. “Según la situación del marcapasos esa era mi vida. Es una vida robada”, dijo Álvarez, que hoy tiene 49 años y una hija de 19.
El de Silvia Álvarez no es cualquier expediente. “Disfunción de marcapasos” salta a la vista en un certificado médico tras otro. Las anotaciones se refieren a dos de los tres marcapasos que le han implantado en el pecho, el primero en 1997, otro más en 2006 y el último en 2008; el diagnóstico se repite en los reportes de las tres otras ocasiones que los médicos abrieron su pecho para reacomodar un cable que se había desprendido, o para reubicar el generador del marcapasos que se había desplazado de lugar. O la última vez que intentaron, sin éxito, remover los cables de un anterior dispositivo que ya se habían adherido firmemente al corazón, lo que explicaba algunos dolores.
“La paciente ha tenido varias cirugías desde que se implantó por primera vez su marcapasos, todas ellas por disfunción, una por desplazamiento del cable atrial, otras por problemas en la estimulación del marcapaso y otras por la posición del generador”, exhibe un resumen clínico del Hospital General Regional No. 1 de Tijuana, de agosto de 2008.
En suma, su expediente arroja una veintena de diagnósticos, de hospitales públicos y privados, y reportes que dan cuenta del deterioro progresivo de su salud: el dolor persistente, los mareos, los desvanecimientos, las fuertes punzadas en el hombro y en el pecho; la dificultad que llegó a tener para mover siquiera los brazos, además de palpitaciones, arritmias, taquicardias y la pérdida fugaz de la visión.
A la fecha, ningún médico le ha explicado qué ocurrió con sus marcapasos Prodigy, de Medtronic, o el Protos, de Biotronik: si sus males se debían a fallas de los dispositivos, como parecen indicar sus registros, o si su corazón rechazó el implante o los médicos fallaron en la instalación .
“Eso jamás me lo aclararon, en todas las notas aparece ‘disfunción’; nosotros preguntábamos a qué se debía y nos decían que un cable se movió y que el generador cambió de posición”. Y nada más.
Resulta difícil imaginar que un caso como el de Silvia pasara inadvertido después de una procesión de tantos años por tantos hospitales. En su expediente y en la recolección que ella y su esposo Julián Hernández Reyes tienen de ese tiempo, no hay registro de que se hubiera acercado algún ejecutivo de la empresa fabricante, o que alguno de sus médicos buscase respuestas con el fabricante.
Ya desde 1998 había una regulación en México que obligaba a la industria a reportar posibles efectos adversos de sus medicamentos e implantes. Pero fue hasta 2013 que la Comisión Nacional para la Protección Contra Riesgos Sanitarios (Cofepris) quedó a cargo de montar un sistema de vigilancia para recibir y atender los reportes de dispositivos médicos.
Una nueva normativa ordenó que se estableciera en México un sistema similar al que funcionaba, hacía dos décadas, para detectar y prevenir las reacciones adversas a los medicamentos, y que depende de un sistema de reporte de efectos adversos que alimentan pacientes, médicos, hospitales y la industria.
Ese sistema hoy día hace posible que lleguen cada año decenas de alertas a médicos y hospitales alrededor del país. Les llevan novedades acerca del uso de ciertos fármacos, los riesgos o interacciones con otros medicamentos, y en ocasiones anuncian el retiro de productos por problemas de seguridad.
Una investigación de Quinto Elemento Lab, Mexicanos Contra la Corrupción y la Impunidad y Proceso, desarrollada con decenas de entrevistas y cientos de solicitudes de información al gobierno federal y a dependencias en 32 estados, revela que este sistema ha fallado en velar por la seguridad de pacientes como Silvia Álvarez Vega.
Este reportaje es parte del proyecto que lideró el Consorcio Internacional de Periodistas de Investigación (ICIJ por sus siglas en inglés), en el cual trabajaron más de 250 periodistas de 58 medios en 36 países, y que ha puesto al descubierto que las autoridades sanitarias no han logrado proteger a millones de pacientes alrededor del mundo, que resultaron con lesiones provocadas por implantes que debían aliviarlos.
La información obtenida vía Transparencia para el caso de México y los testimonios de pacientes y médicos así lo confirmaron.
El Instituto Mexicano del Seguro Social realiza casi 1.5 millones de cirugías al año, y no ha reportado un solo incidente adverso de 2006 a la fecha, lapso de años de los que se solicitó la información. Lo mismo ocurre con el ISSSTE, otro de los mayores sistemas de salud en el país. Ninguno respondió a las solicitudes de entrevista.
En el Instituto Nacional de Cardiología, el responsable de vigilar fármacos desconocía hace unas semanas si alguien ahí da seguimiento al tema de dispositivos, y en el Instituto Nacional de Pediatría, apenas desde mediados de año tienen a personal para dar seguimiento a posibles reportes.
Según la Cofepris, de 2013 a la fecha han llegado a sus manos dos mil 254 reportes de incidentes adversos ocasionados por dispositivos en diversas regiones del país.
Una diferencia considerable, si se compara con los 5.4 millones de reportes que enviaron los fabricantes, médicos, abogados y pacientes en la última década, a la agencia del gobierno estadounidense a cargo de la vigilancia, la Food and Drug Administration (FDA), y que fueron analizados por ICIJ. Estos reportes a la FDA están relacionados con 1.7 millones de lesiones y 83 mil muertes de personas.
Lo que la investigación también encontró es que en EU hubo 26 mil 700 retiros de dispositivos en la última década y ocho mil 300 en Canadá. México, que es uno de los más grandes mercados de dispositivos en América Latina, sólo reportó dos y ambos productos eran de bajo riesgo. El primero fue una cánula –un delgado tubo que se introduce en una incisión en la piel del paciente para explorar sus articulaciones- y el otro fue un tubo de gel lubricante sexual.
La vigilancia de los dispositivos médicos es importante por tratarse de equipos que se implantan dentro del cuerpo y porque, según reveló la investigacIón internacional de ICIJ, los gobiernos imponen estándares de seguridad más bajos a los implantes médicos que a las medicinas. (https://goo.gl/r59vtW)
Es también pertinente por el gran empuje que tienen la industria y su brazo comercial. Solo en México hay casi 40,000 productos autorizados y la colección crece en 2,500 permisos por año.
Una industria crece
El gobierno considera a éste un sector estratégico. Las más grandes empresas del mundo tienen fábricas aquí, sobre todo en Tijuana y el corredor de la frontera norte; México ya aparece en el lugar ocho entre los exportadores de dispositivos más grandes en el mundo.
No solo eso. México es un importante mercado para sus productos -les dio ventas por nueve mil 568 mdd en 2017 y crecerá en los próximos años, indican análisis del mercado. Una gran porción de la población de México está entrando a la edad adulta; los mayores de 50 años están siempre entre los mejores clientes de este sector que desarrolla, fabrica y vende prótesis de columna para aliviar el dolor de personas con vértebras dañadas; stents que puestos en las arterias han salvado la vida a millones de personas con cardiopatías.
Sin embargo, según las fuentes consultadas, el gobierno federal ha puesto más atención en ayudar a la industria a crecer que en desarrollar un aparato robusto que vigile la seguridad de los dispositivos que están siendo utilizados.
Cofepris presumió hace unos meses que logró dar trámite a más de 19,000 solicitudes de permiso en un tiempo récord de tres a 15 días, cuando es algo que suele resolver en meses.
En contraste, la plataforma que abrió en internet para recibir reportes de los médicos y ciudadanos lleva casi un año caída; funciona con intermitencias desde el terremoto de 2017.
El área que da seguimiento a los dispositivos médicos tenía seis integrantes en 2013 -
tres ingenieros, una química y dos pasantes-. Para 2015, el equipo había sumado un integrante más, según Lorena Garza de Allende, primera encargada del departamento.
De acuerdo con las fuentes consultadas, este pequeño equipo de Cofepris tiene a su cargo una tarea descomunal. Deben revisar el informe que cada cinco años entregan las empresas para renovar su permiso, y que contiene información sobre los incidentes adversos que se suscitaron y las medidas de seguridad que tomó, dijo Garza, actual vicepresidenta del Colegio de Ingenieros Biomédicos de México.
Los técnicos deben entrenar a médicos alrededor del país para que aprendan a identificar y a reportar un posible incidente adverso y dar a conocer entre pacientes que, también ellos, tienen derecho a reportar y cómo hacerlo. Además les toca atender los reportes de incidentes adversos y asegurarse que la industria investigue. Porque, según la norma mexicana que regula a los dispositivos, son las empresas las que deben investigar.
A contrapelo de la política de la FDA y de otras agencias alrededor del mundo, que hacen pública la información de los reportes y la hacen circular al público, a la comunidad médica y la industria, la Cofepris mantiene la información reservada.
Según datos oficiales, en los últimos cinco años, la industria investigó 55 casos de incidentes graves en pacientes en México, pero la Cofepris negó revelar los detalles. Reservó el nombre del dispositivo, la marca y el modelo y los daños que provocó. Esa es información que sí publican los órganos de vigilancia de otros países.
“En caso de que se diera a conocer la información contenida en los expedientes de tecnovigilancia, la población podría suponer que un determinado dispositivo médico produce determinados incidentes adversos cuando no es así”, respondió la Cofepris a las solicitudes de información. La dependencia no atendió a repetidas solicitudes de entrevista hechas en el último mes.
 Sin cultura del reporte
Una tarde de junio en un salón del WTC Ciudad de México, medio centenar de especialistas de la industria, funcionarios y médicos atendieron a un panel acerca de la regulación de dispositivos.
Afuera, en el área de la exposición, representantes de compañías de EU, China y Corea conducían a los visitantes hasta sus exhibidores, para mostrarles una colección de cánulas y vastas series de clavos, tornillos y placas para arreglar, seguramente, muy dolorosos problemas de huesos.
“No es sólo tener un registro y vender -creo que eso es lo que hacemos ahora-”, dijo al micrófono María Gracia Fuentes, gerente de Asuntos Regulatorios de la trasnacional GE Healthcare en el salón vecino a la expo. “El reto más grande es ver qué pasa después: tener bases de datos confiables de lo que está pasando en el mercado”, dijo a sus colegas.
Casi cada una de las demás intervenciones de la tarde tocaron, aunque fuera de filón, el tema de la falta de reportes de incidentes adversos y el seguimiento. “Necesitamos alentar una cultura del reporte, por mínimo que sea el efecto adverso”, dijo Octavio Cruz Martínez, quien desde hace ocho años es jefe de la oficina que atiende reportes de medicamentos y dispositivos en el Hospital HMG de Coyoacán, en la capital.
Desde su pequeña oficina, a un costado del área de Epidemiología del hospital, Cruz Martínez recordó las visitas frecuentes que hacía antes el personal de Cofepris para capacitar a los empleados del hospital para que pudieran recibir y reportar efectos adversos de fármacos. No ocurrió lo mismo cuando se volvió obligatorio vigilar a los dispositivos.
Hasta ahora, las fallas más recurrentes que han llegado a la oficina de Cruz Martínez tienen que ver con tiras reactivas de glucómetros, medios de contraste, equipos para medir la presión, catéteres y mascarillas.
El reporte más grave se refiere a un incidente que ocurrió durante una cirugía, hace cinco años, cuando falló una engrapadora. En aquella ocasión notificaron el evento a Cofepris y al proveedor, pero nunca tuvieron respuesta. El hospital optó por desechar el producto sobrante y suspender la compra de esa marca.
Según Cruz, cuando se trata de medicamentos, la reacción de las empresas farmacéuticas suele ser diligente, visitan el hospital, lo que no sucede con los proveedores de dispositivos.
“El fabricante de dispositivos saca un producto al mercado y lo abandona (…) no le importa tanto qué está pasando con su producto, hasta que no ve que ya los van a retirar porque causaron varios eventos significativamente importantes”, dijo.
Sin cultura del reporte
Una tarde de junio en un salón del WTC Ciudad de México, medio centenar de especialistas de la industria, funcionarios y médicos atendieron a un panel acerca de la regulación de dispositivos.
Afuera, en el área de la exposición, representantes de compañías de EU, China y Corea conducían a los visitantes hasta sus exhibidores, para mostrarles una colección de cánulas y vastas series de clavos, tornillos y placas para arreglar, seguramente, muy dolorosos problemas de huesos.
“No es sólo tener un registro y vender -creo que eso es lo que hacemos ahora-”, dijo al micrófono María Gracia Fuentes, gerente de Asuntos Regulatorios de la trasnacional GE Healthcare en el salón vecino a la expo. “El reto más grande es ver qué pasa después: tener bases de datos confiables de lo que está pasando en el mercado”, dijo a sus colegas.
Casi cada una de las demás intervenciones de la tarde tocaron, aunque fuera de filón, el tema de la falta de reportes de incidentes adversos y el seguimiento. “Necesitamos alentar una cultura del reporte, por mínimo que sea el efecto adverso”, dijo Octavio Cruz Martínez, quien desde hace ocho años es jefe de la oficina que atiende reportes de medicamentos y dispositivos en el Hospital HMG de Coyoacán, en la capital.
Desde su pequeña oficina, a un costado del área de Epidemiología del hospital, Cruz Martínez recordó las visitas frecuentes que hacía antes el personal de Cofepris para capacitar a los empleados del hospital para que pudieran recibir y reportar efectos adversos de fármacos. No ocurrió lo mismo cuando se volvió obligatorio vigilar a los dispositivos.
Hasta ahora, las fallas más recurrentes que han llegado a la oficina de Cruz Martínez tienen que ver con tiras reactivas de glucómetros, medios de contraste, equipos para medir la presión, catéteres y mascarillas.
El reporte más grave se refiere a un incidente que ocurrió durante una cirugía, hace cinco años, cuando falló una engrapadora. En aquella ocasión notificaron el evento a Cofepris y al proveedor, pero nunca tuvieron respuesta. El hospital optó por desechar el producto sobrante y suspender la compra de esa marca.
Según Cruz, cuando se trata de medicamentos, la reacción de las empresas farmacéuticas suele ser diligente, visitan el hospital, lo que no sucede con los proveedores de dispositivos.
“El fabricante de dispositivos saca un producto al mercado y lo abandona (…) no le importa tanto qué está pasando con su producto, hasta que no ve que ya los van a retirar porque causaron varios eventos significativamente importantes”, dijo.
 Una alerta que llegó tarde
En agosto de 2011, un año después de que un médico diagnosticó a su hijo de nueve años con diabetes tipo 1, la aseguradora del ingeniero Víctor Aarón Vázquez Gandarilla y su esposa les autorizó la compra de una bomba de insulina Paradigm, fabricada por la compañía trasnacional Medtronic. Este dispositivo suple la función del páncreas al liberar insulina de manera continua.
Les ilusionó pensar que ese aparato iba a darle más libertades a su hijo. Podría correr otra vez y comer como los demás niños en la Primaria, dormir tranquilo y despreocuparse de la rutina de inyectarse cuatro veces en el día.
El vendedor solo les hizo dos advertencias. Ninguna de ellas les hizo pensar que la bomba podría poner en riesgo la vida del pequeño.
Una llamada de la escuela los puso sobre aviso en 2012. El niño tenía un fuerte dolor de estómago y niveles de glucosa como nunca los había tenido. Los Vázquez lo llevaron a toda prisa al hospital Ángeles de Chihuahua. El pequeño cayó en un episodio de cetoacidosis severa, dijo Víctor Vázquez. Sus células dejaron de recibir la glucosa que necesitan como fuente de energía. El niño estuvo muy cerca de caer en un coma diabético.
Los médicos no explicaron qué disparó esta crisis y una vez fuera del hospital, días más tarde, los Vázquez decidieron volver a la coreografía de las inyecciones diarias. El vendedor del aparato no devolvió sus llamadas y decidieron abandonar el uso del dispositivo.
Ocho meses más tarde llegó la explicación que había faltado, en un mail con una alerta de seguridad a clientes de la bomba de insulina Paradigm. La compañía Medtronic les avisaba del riesgo posible de que la bomba pudiera administrar una cantidad excesiva o insuficiente de insulina.
La explicación que no les dieron los médicos, había llegado al fin.
Víctor Vázquez escribió a la empresa en México y a otras 16 direcciones en Estados Unidos. El área Legal de Medtronic para México y Centroamérica le respondió vía correo electrónico. Querían revisar el equipo. “Medtronic está dispuesta a compartir los protocolos de exámenes y pruebas propuestas con usted, si usted se compromete a mantener cualquier tipo de información del protocolo como confidencial”, ofrecieron a cambio.
La familia Vázquez no aceptó esa condición y, asesorados por una abogada, pidieron una indemnización que Medtronic declinó, según respondió la encargada de Asuntos Legales en septiembre de 2013.
Aunque ese mismo año entró en vigor la norma de tecnovigilancia, Víctor Vázquez nunca presentó un reporte de incidente adverso a Cofepris. No sabía que podía hacerlo.
En lugar de eso, Víctor Vázquez creó un grupo de Facebook para advertir a los padres de otros niños sobre los potenciales riesgos asociados a la bomba. Ahí publica las noticias y alertas que emiten los gobiernos de otros países.
Un análisis del ICIJ a la base de datos de la FDA revela que, en el último decenio, las bombas de insulina de Medtronic estarían relacionadas con más de mil 800 muertes y cerca de 96 mil lesiones a pacientes, cifras que superan a cualquier otro dispositivo médico. En México, la Cofepris sólo registra cuatro incidentes adversos.
Información bajo reserva
El sistema de vigilancia de la Cofepris es presentado como un modelo que toma lo mejor de las agencias internacionales y de la experiencia mexicana en el seguimiento a medicinas.
Pero a diferencia de otras agencias en el mundo, Cofepris no comunica al público o a la comunidad médica el detalle de lo que ocurre con los implantes.
La base de datos de incidentes de la FDA es pública, aún cuando falta investigar estos reportes; no son evidencia todavía de que los dispositivos hayan causado las lesiones o muertes.
Cofepris respondió a una solicitud de información proporcionando la base de datos de incidentes adversos, con información tachada: debajo de placas negras quedaron el nombre del fabricante, la marca del dispositivo y, en ocasiones, la descripción del incidente y del daño que presumiblemente causó.
Los directivos de las asociaciones nacionales de Cardiología, Ginecología, Obesidad y Diabetes, dijeron en entrevista que Cofepris nunca les ha compartido información sobre alertas, o avisos de seguridad y riesgos con implantes y equipos.
Según sus propios registros, Cofepris solo ha emitido tres alertas. Las tres avisaban al público de productos a la venta que no tenían autorización, entre ellas una copa menstrual, pruebas de detección de VIH y una serie de tornillos, placas y prótesis, sin permiso, que decomisó en las instalaciones de una empresa.
“Cofepris nunca ha emitido un listado, como lo hace en los fármacos, en el que diga que en este año, 2018, han tenido esta lista de dispositivos que ya están retirados, o no se recomienda su uso por el riesgo”, dijo Octavio Cruz, del Hospital HMG. En contraste, a su computadora llegan hasta 20 alertas de Cofepris relacionadas con medicamentos, cada año.
Desde el piso 38 en el WTC donde están las oficinas del Colegio Mexicano de Especialistas en Ginecología y Obstetricia, su presidente Eduardo Sirahuén Neri cuenta que, ante la falta de información oficial, los médicos suelen echar mano de la información de la FDA y agencias europeas para mantenerse al tanto.
Fue en las alertas de la FDA, por ejemplo, que supo del retiro de algunas mallas que han servido para evitar la caída de órganos vaginales.
Una alerta que llegó tarde
En agosto de 2011, un año después de que un médico diagnosticó a su hijo de nueve años con diabetes tipo 1, la aseguradora del ingeniero Víctor Aarón Vázquez Gandarilla y su esposa les autorizó la compra de una bomba de insulina Paradigm, fabricada por la compañía trasnacional Medtronic. Este dispositivo suple la función del páncreas al liberar insulina de manera continua.
Les ilusionó pensar que ese aparato iba a darle más libertades a su hijo. Podría correr otra vez y comer como los demás niños en la Primaria, dormir tranquilo y despreocuparse de la rutina de inyectarse cuatro veces en el día.
El vendedor solo les hizo dos advertencias. Ninguna de ellas les hizo pensar que la bomba podría poner en riesgo la vida del pequeño.
Una llamada de la escuela los puso sobre aviso en 2012. El niño tenía un fuerte dolor de estómago y niveles de glucosa como nunca los había tenido. Los Vázquez lo llevaron a toda prisa al hospital Ángeles de Chihuahua. El pequeño cayó en un episodio de cetoacidosis severa, dijo Víctor Vázquez. Sus células dejaron de recibir la glucosa que necesitan como fuente de energía. El niño estuvo muy cerca de caer en un coma diabético.
Los médicos no explicaron qué disparó esta crisis y una vez fuera del hospital, días más tarde, los Vázquez decidieron volver a la coreografía de las inyecciones diarias. El vendedor del aparato no devolvió sus llamadas y decidieron abandonar el uso del dispositivo.
Ocho meses más tarde llegó la explicación que había faltado, en un mail con una alerta de seguridad a clientes de la bomba de insulina Paradigm. La compañía Medtronic les avisaba del riesgo posible de que la bomba pudiera administrar una cantidad excesiva o insuficiente de insulina.
La explicación que no les dieron los médicos, había llegado al fin.
Víctor Vázquez escribió a la empresa en México y a otras 16 direcciones en Estados Unidos. El área Legal de Medtronic para México y Centroamérica le respondió vía correo electrónico. Querían revisar el equipo. “Medtronic está dispuesta a compartir los protocolos de exámenes y pruebas propuestas con usted, si usted se compromete a mantener cualquier tipo de información del protocolo como confidencial”, ofrecieron a cambio.
La familia Vázquez no aceptó esa condición y, asesorados por una abogada, pidieron una indemnización que Medtronic declinó, según respondió la encargada de Asuntos Legales en septiembre de 2013.
Aunque ese mismo año entró en vigor la norma de tecnovigilancia, Víctor Vázquez nunca presentó un reporte de incidente adverso a Cofepris. No sabía que podía hacerlo.
En lugar de eso, Víctor Vázquez creó un grupo de Facebook para advertir a los padres de otros niños sobre los potenciales riesgos asociados a la bomba. Ahí publica las noticias y alertas que emiten los gobiernos de otros países.
Un análisis del ICIJ a la base de datos de la FDA revela que, en el último decenio, las bombas de insulina de Medtronic estarían relacionadas con más de mil 800 muertes y cerca de 96 mil lesiones a pacientes, cifras que superan a cualquier otro dispositivo médico. En México, la Cofepris sólo registra cuatro incidentes adversos.
Información bajo reserva
El sistema de vigilancia de la Cofepris es presentado como un modelo que toma lo mejor de las agencias internacionales y de la experiencia mexicana en el seguimiento a medicinas.
Pero a diferencia de otras agencias en el mundo, Cofepris no comunica al público o a la comunidad médica el detalle de lo que ocurre con los implantes.
La base de datos de incidentes de la FDA es pública, aún cuando falta investigar estos reportes; no son evidencia todavía de que los dispositivos hayan causado las lesiones o muertes.
Cofepris respondió a una solicitud de información proporcionando la base de datos de incidentes adversos, con información tachada: debajo de placas negras quedaron el nombre del fabricante, la marca del dispositivo y, en ocasiones, la descripción del incidente y del daño que presumiblemente causó.
Los directivos de las asociaciones nacionales de Cardiología, Ginecología, Obesidad y Diabetes, dijeron en entrevista que Cofepris nunca les ha compartido información sobre alertas, o avisos de seguridad y riesgos con implantes y equipos.
Según sus propios registros, Cofepris solo ha emitido tres alertas. Las tres avisaban al público de productos a la venta que no tenían autorización, entre ellas una copa menstrual, pruebas de detección de VIH y una serie de tornillos, placas y prótesis, sin permiso, que decomisó en las instalaciones de una empresa.
“Cofepris nunca ha emitido un listado, como lo hace en los fármacos, en el que diga que en este año, 2018, han tenido esta lista de dispositivos que ya están retirados, o no se recomienda su uso por el riesgo”, dijo Octavio Cruz, del Hospital HMG. En contraste, a su computadora llegan hasta 20 alertas de Cofepris relacionadas con medicamentos, cada año.
Desde el piso 38 en el WTC donde están las oficinas del Colegio Mexicano de Especialistas en Ginecología y Obstetricia, su presidente Eduardo Sirahuén Neri cuenta que, ante la falta de información oficial, los médicos suelen echar mano de la información de la FDA y agencias europeas para mantenerse al tanto.
Fue en las alertas de la FDA, por ejemplo, que supo del retiro de algunas mallas que han servido para evitar la caída de órganos vaginales.
 Salud en riesgo
María de la Luz Vanegas García, una abogada de 39 años de la Ciudad de México, encontró más información en redes sociales de la que logró de sus médicos.
Fue a finales de 2012 cuando le implantaron un anticonceptivo que se llama Essure, del laboratorio Bayer y que consiste en un par de resortes de metal que se insertan en las trompas de Falopio.
Luz Vanegas asegura que los dolores de cabeza y abdomen, la fatiga y los piquetes en el vientre comenzaron poco tiempo después de la operación y no la han abandonado en seis años.
Vanegas ha visto varios especialistas y de ninguno de ellos escuchó la información que, en cambio, encontró en grupos cerrados de Facebook en el que participan mujeres de diversos países, que viven con el dispositivo. Este año, un documental en Netflix le acabó de abrir los ojos. Se enteró que los resortes del Essure pueden encarnarse en las trompas de Falopio y que en ocasiones es necesario extirpar las trompas o el útero completo, para remover el dispositivo.
De acuerdo con documentos del gobierno de EU, la FDA recibió 26 mil 773 reportes de incidentes relacionados con este producto, entre 2002 y 2017.
Aunque la agencia estadounidense sostiene que los beneficios del Essure superan los riesgos, en los últimos años dispuso una serie de medidas para que las clientas estén informadas de las implicaciones que puede traer su uso.
Fernando Contreras, director de Gynecon, la empresa que fue autorizada a comercializar el Essure en México, estima que cerca de 900 mujeres en México se instalaron este anticonceptivo en los años que estuvo a la venta aquí, y no ha sabido que hubiera problemas.
Aunque en México no hay reportes de incidentes adversos, Contreras recuerda que Bayer le hacía llegar notificaciones de otros países. “Al principio los revisaba”, dijo, “pero cuando me di cuenta que eran de Inglaterra, de Francia, pues tengo mucho trabajo como para estar revisando todos los que no tienen que ver con nosotros.... Los que yo alcancé a leer los catalogaban como no graves, porque después ya ni los leía”.
El sistema de reportes es, en todos los países, la piedra angular del sistema de vigilancia.
En México se reporta poco, y a menudo se reporta mal. “Uno de los posibles problemas en los sistemas de detección y cuantificación de incidentes adversos es la falta de calidad en la información proporcionada en las notificaciones de incidentes adversos” argumentó Cofepris a una solicitud de información.
Quinto Elemento Lab, MCCI y Proceso recibieron 564 reportes de incidentes adversos que enviaron a Cofepris una serie de dependencias de salud en 16 estados y cuatro hospitales e institutos de especialidad.
La mayoría reportó defectos de calidad en productos de menor riesgo que un implante, como guantes rotos, telas adhesivas que irritaban la piel y tijeras sin filo, además de inconvenientes con medios de contraste, glucómetros, vendas y pinzas.
Sólo una tercera parte de los reportes tiene información suficiente para identificar plenamente el producto y solo uno de cada cinco reportes incluye el nombre del fabricante o distribuidor.
Remedios para el dolor
Silvia Álvarez Vega hace mucho tiempo perdió la cuenta del número de veces que ingresó a salas de Urgencias por complicaciones derivadas del primero y segundo marcapasos.
Ella estaba a unos meses de casarse con Julián cuando le pusieron el primer dispositivo. Su hija Elisa apenas tenía un año cuando Silvia salió de una cirugía en la que intentaron reacomodarle un cable; Silvia pudo cargar a su hija muy poco en sus primeros años de vida.
En el comedor de su departamento, en la Roma Norte, están guardadas en cajas de cartón miles de hojas con los estudios y diagnósticos de especialistas y la papelería que presentó a docenas de instituciones, buscando que alguna tomara su caso. Lo que no ha ocurrido aún.
Ese desamparo, dice Silvia, le causó un dolor profundo. “El sentirme ignorada, condenada a llevar una vida a medias o menos que medias”, dijo.
Por eso comenzó a pintar. Los más grandes cuadros que descansan en el piso y las paredes de su pequeño estudio, retratan la impotencia y el dolor de esos días.
La pintura fue el recurso que ella encontró para hacer frente y procesar ese desasosiego que aún persiste. La batería del generador de su tercer marcapaso está por agotarse y será necesario que vuelvan a operarla a fines de este año, y hacer el reemplazo. Silvia Álvarez se aferra a seguir luchando. “Merezco una oportunidad por todo el daño que me hicieron”.
Salud en riesgo
María de la Luz Vanegas García, una abogada de 39 años de la Ciudad de México, encontró más información en redes sociales de la que logró de sus médicos.
Fue a finales de 2012 cuando le implantaron un anticonceptivo que se llama Essure, del laboratorio Bayer y que consiste en un par de resortes de metal que se insertan en las trompas de Falopio.
Luz Vanegas asegura que los dolores de cabeza y abdomen, la fatiga y los piquetes en el vientre comenzaron poco tiempo después de la operación y no la han abandonado en seis años.
Vanegas ha visto varios especialistas y de ninguno de ellos escuchó la información que, en cambio, encontró en grupos cerrados de Facebook en el que participan mujeres de diversos países, que viven con el dispositivo. Este año, un documental en Netflix le acabó de abrir los ojos. Se enteró que los resortes del Essure pueden encarnarse en las trompas de Falopio y que en ocasiones es necesario extirpar las trompas o el útero completo, para remover el dispositivo.
De acuerdo con documentos del gobierno de EU, la FDA recibió 26 mil 773 reportes de incidentes relacionados con este producto, entre 2002 y 2017.
Aunque la agencia estadounidense sostiene que los beneficios del Essure superan los riesgos, en los últimos años dispuso una serie de medidas para que las clientas estén informadas de las implicaciones que puede traer su uso.
Fernando Contreras, director de Gynecon, la empresa que fue autorizada a comercializar el Essure en México, estima que cerca de 900 mujeres en México se instalaron este anticonceptivo en los años que estuvo a la venta aquí, y no ha sabido que hubiera problemas.
Aunque en México no hay reportes de incidentes adversos, Contreras recuerda que Bayer le hacía llegar notificaciones de otros países. “Al principio los revisaba”, dijo, “pero cuando me di cuenta que eran de Inglaterra, de Francia, pues tengo mucho trabajo como para estar revisando todos los que no tienen que ver con nosotros.... Los que yo alcancé a leer los catalogaban como no graves, porque después ya ni los leía”.
El sistema de reportes es, en todos los países, la piedra angular del sistema de vigilancia.
En México se reporta poco, y a menudo se reporta mal. “Uno de los posibles problemas en los sistemas de detección y cuantificación de incidentes adversos es la falta de calidad en la información proporcionada en las notificaciones de incidentes adversos” argumentó Cofepris a una solicitud de información.
Quinto Elemento Lab, MCCI y Proceso recibieron 564 reportes de incidentes adversos que enviaron a Cofepris una serie de dependencias de salud en 16 estados y cuatro hospitales e institutos de especialidad.
La mayoría reportó defectos de calidad en productos de menor riesgo que un implante, como guantes rotos, telas adhesivas que irritaban la piel y tijeras sin filo, además de inconvenientes con medios de contraste, glucómetros, vendas y pinzas.
Sólo una tercera parte de los reportes tiene información suficiente para identificar plenamente el producto y solo uno de cada cinco reportes incluye el nombre del fabricante o distribuidor.
Remedios para el dolor
Silvia Álvarez Vega hace mucho tiempo perdió la cuenta del número de veces que ingresó a salas de Urgencias por complicaciones derivadas del primero y segundo marcapasos.
Ella estaba a unos meses de casarse con Julián cuando le pusieron el primer dispositivo. Su hija Elisa apenas tenía un año cuando Silvia salió de una cirugía en la que intentaron reacomodarle un cable; Silvia pudo cargar a su hija muy poco en sus primeros años de vida.
En el comedor de su departamento, en la Roma Norte, están guardadas en cajas de cartón miles de hojas con los estudios y diagnósticos de especialistas y la papelería que presentó a docenas de instituciones, buscando que alguna tomara su caso. Lo que no ha ocurrido aún.
Ese desamparo, dice Silvia, le causó un dolor profundo. “El sentirme ignorada, condenada a llevar una vida a medias o menos que medias”, dijo.
Por eso comenzó a pintar. Los más grandes cuadros que descansan en el piso y las paredes de su pequeño estudio, retratan la impotencia y el dolor de esos días.
La pintura fue el recurso que ella encontró para hacer frente y procesar ese desasosiego que aún persiste. La batería del generador de su tercer marcapaso está por agotarse y será necesario que vuelvan a operarla a fines de este año, y hacer el reemplazo. Silvia Álvarez se aferra a seguir luchando. “Merezco una oportunidad por todo el daño que me hicieron”.
 Silvia Álvarez tenía 25 años y estudiaba Arquitectura en la UAM cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. En 1997 le instalaron el primero de tres marcapasos. Foto: Nadia Baram[/caption]
Apenas tenía 25 años, estudiaba Arquitectura en la Universidad Autónoma Metropolitana, cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. El diagnóstico más improbable para una mujer que entrenaba con intensidad para competir en la liga nacional de atletismo.
La única alternativa que le dieron los médicos para poner fin a los recurrentes desmayos era implantarle un marcapasos que estimulara su corazón. La primera vez que entró a quirófano fue el 4 de junio de 1997, en el hospital Siglo XXI de la Ciudad de México.
El día que le instalaron el remedio, comenzó la verdadera pesadilla. Todo está plasmado en un expediente con cientos de páginas. “El marcapasos fue lo que me arruinó porque me la vivía en el hospital”, dijo una tarde de octubre sentada en el comedor de su casa de la colonia Roma, en la Ciudad de México. “Según la situación del marcapasos esa era mi vida. Es una vida robada”, dijo Álvarez, que hoy tiene 49 años y una hija de 19.
El de Silvia Álvarez no es cualquier expediente. “Disfunción de marcapasos” salta a la vista en un certificado médico tras otro. Las anotaciones se refieren a dos de los tres marcapasos que le han implantado en el pecho, el primero en 1997, otro más en 2006 y el último en 2008; el diagnóstico se repite en los reportes de las tres otras ocasiones que los médicos abrieron su pecho para reacomodar un cable que se había desprendido, o para reubicar el generador del marcapasos que se había desplazado de lugar. O la última vez que intentaron, sin éxito, remover los cables de un anterior dispositivo que ya se habían adherido firmemente al corazón, lo que explicaba algunos dolores.
“La paciente ha tenido varias cirugías desde que se implantó por primera vez su marcapasos, todas ellas por disfunción, una por desplazamiento del cable atrial, otras por problemas en la estimulación del marcapaso y otras por la posición del generador”, exhibe un resumen clínico del Hospital General Regional No. 1 de Tijuana, de agosto de 2008.
En suma, su expediente arroja una veintena de diagnósticos, de hospitales públicos y privados, y reportes que dan cuenta del deterioro progresivo de su salud: el dolor persistente, los mareos, los desvanecimientos, las fuertes punzadas en el hombro y en el pecho; la dificultad que llegó a tener para mover siquiera los brazos, además de palpitaciones, arritmias, taquicardias y la pérdida fugaz de la visión.
A la fecha, ningún médico le ha explicado qué ocurrió con sus marcapasos Prodigy, de Medtronic, o el Protos, de Biotronik: si sus males se debían a fallas de los dispositivos, como parecen indicar sus registros, o si su corazón rechazó el implante o los médicos fallaron en la instalación .
“Eso jamás me lo aclararon, en todas las notas aparece ‘disfunción’; nosotros preguntábamos a qué se debía y nos decían que un cable se movió y que el generador cambió de posición”. Y nada más.
Resulta difícil imaginar que un caso como el de Silvia pasara inadvertido después de una procesión de tantos años por tantos hospitales. En su expediente y en la recolección que ella y su esposo Julián Hernández Reyes tienen de ese tiempo, no hay registro de que se hubiera acercado algún ejecutivo de la empresa fabricante, o que alguno de sus médicos buscase respuestas con el fabricante.
Ya desde 1998 había una regulación en México que obligaba a la industria a reportar posibles efectos adversos de sus medicamentos e implantes. Pero fue hasta 2013 que la Comisión Nacional para la Protección Contra Riesgos Sanitarios (Cofepris) quedó a cargo de montar un sistema de vigilancia para recibir y atender los reportes de dispositivos médicos.
Una nueva normativa ordenó que se estableciera en México un sistema similar al que funcionaba, hacía dos décadas, para detectar y prevenir las reacciones adversas a los medicamentos, y que depende de un sistema de reporte de efectos adversos que alimentan pacientes, médicos, hospitales y la industria.
Ese sistema hoy día hace posible que lleguen cada año decenas de alertas a médicos y hospitales alrededor del país. Les llevan novedades acerca del uso de ciertos fármacos, los riesgos o interacciones con otros medicamentos, y en ocasiones anuncian el retiro de productos por problemas de seguridad.
Una investigación de Quinto Elemento Lab, Mexicanos Contra la Corrupción y la Impunidad y Proceso, desarrollada con decenas de entrevistas y cientos de solicitudes de información al gobierno federal y a dependencias en 32 estados, revela que este sistema ha fallado en velar por la seguridad de pacientes como Silvia Álvarez Vega.
Este reportaje es parte del proyecto que lideró el Consorcio Internacional de Periodistas de Investigación (ICIJ por sus siglas en inglés), en el cual trabajaron más de 250 periodistas de 58 medios en 36 países, y que ha puesto al descubierto que las autoridades sanitarias no han logrado proteger a millones de pacientes alrededor del mundo, que resultaron con lesiones provocadas por implantes que debían aliviarlos.
La información obtenida vía Transparencia para el caso de México y los testimonios de pacientes y médicos así lo confirmaron.
El Instituto Mexicano del Seguro Social realiza casi 1.5 millones de cirugías al año, y no ha reportado un solo incidente adverso de 2006 a la fecha, lapso de años de los que se solicitó la información. Lo mismo ocurre con el ISSSTE, otro de los mayores sistemas de salud en el país. Ninguno respondió a las solicitudes de entrevista.
En el Instituto Nacional de Cardiología, el responsable de vigilar fármacos desconocía hace unas semanas si alguien ahí da seguimiento al tema de dispositivos, y en el Instituto Nacional de Pediatría, apenas desde mediados de año tienen a personal para dar seguimiento a posibles reportes.
Según la Cofepris, de 2013 a la fecha han llegado a sus manos dos mil 254 reportes de incidentes adversos ocasionados por dispositivos en diversas regiones del país.
Una diferencia considerable, si se compara con los 5.4 millones de reportes que enviaron los fabricantes, médicos, abogados y pacientes en la última década, a la agencia del gobierno estadounidense a cargo de la vigilancia, la Food and Drug Administration (FDA), y que fueron analizados por ICIJ. Estos reportes a la FDA están relacionados con 1.7 millones de lesiones y 83 mil muertes de personas.
Lo que la investigación también encontró es que en EU hubo 26 mil 700 retiros de dispositivos en la última década y ocho mil 300 en Canadá. México, que es uno de los más grandes mercados de dispositivos en América Latina, sólo reportó dos y ambos productos eran de bajo riesgo. El primero fue una cánula –un delgado tubo que se introduce en una incisión en la piel del paciente para explorar sus articulaciones- y el otro fue un tubo de gel lubricante sexual.
La vigilancia de los dispositivos médicos es importante por tratarse de equipos que se implantan dentro del cuerpo y porque, según reveló la investigacIón internacional de ICIJ, los gobiernos imponen estándares de seguridad más bajos a los implantes médicos que a las medicinas. (https://goo.gl/r59vtW)
Es también pertinente por el gran empuje que tienen la industria y su brazo comercial. Solo en México hay casi 40,000 productos autorizados y la colección crece en 2,500 permisos por año.
Una industria crece
El gobierno considera a éste un sector estratégico. Las más grandes empresas del mundo tienen fábricas aquí, sobre todo en Tijuana y el corredor de la frontera norte; México ya aparece en el lugar ocho entre los exportadores de dispositivos más grandes en el mundo.
No solo eso. México es un importante mercado para sus productos -les dio ventas por nueve mil 568 mdd en 2017 y crecerá en los próximos años, indican análisis del mercado. Una gran porción de la población de México está entrando a la edad adulta; los mayores de 50 años están siempre entre los mejores clientes de este sector que desarrolla, fabrica y vende prótesis de columna para aliviar el dolor de personas con vértebras dañadas; stents que puestos en las arterias han salvado la vida a millones de personas con cardiopatías.
Sin embargo, según las fuentes consultadas, el gobierno federal ha puesto más atención en ayudar a la industria a crecer que en desarrollar un aparato robusto que vigile la seguridad de los dispositivos que están siendo utilizados.
Cofepris presumió hace unos meses que logró dar trámite a más de 19,000 solicitudes de permiso en un tiempo récord de tres a 15 días, cuando es algo que suele resolver en meses.
En contraste, la plataforma que abrió en internet para recibir reportes de los médicos y ciudadanos lleva casi un año caída; funciona con intermitencias desde el terremoto de 2017.
El área que da seguimiento a los dispositivos médicos tenía seis integrantes en 2013 -
tres ingenieros, una química y dos pasantes-. Para 2015, el equipo había sumado un integrante más, según Lorena Garza de Allende, primera encargada del departamento.
De acuerdo con las fuentes consultadas, este pequeño equipo de Cofepris tiene a su cargo una tarea descomunal. Deben revisar el informe que cada cinco años entregan las empresas para renovar su permiso, y que contiene información sobre los incidentes adversos que se suscitaron y las medidas de seguridad que tomó, dijo Garza, actual vicepresidenta del Colegio de Ingenieros Biomédicos de México.
Los técnicos deben entrenar a médicos alrededor del país para que aprendan a identificar y a reportar un posible incidente adverso y dar a conocer entre pacientes que, también ellos, tienen derecho a reportar y cómo hacerlo. Además les toca atender los reportes de incidentes adversos y asegurarse que la industria investigue. Porque, según la norma mexicana que regula a los dispositivos, son las empresas las que deben investigar.
A contrapelo de la política de la FDA y de otras agencias alrededor del mundo, que hacen pública la información de los reportes y la hacen circular al público, a la comunidad médica y la industria, la Cofepris mantiene la información reservada.
Según datos oficiales, en los últimos cinco años, la industria investigó 55 casos de incidentes graves en pacientes en México, pero la Cofepris negó revelar los detalles. Reservó el nombre del dispositivo, la marca y el modelo y los daños que provocó. Esa es información que sí publican los órganos de vigilancia de otros países.
“En caso de que se diera a conocer la información contenida en los expedientes de tecnovigilancia, la población podría suponer que un determinado dispositivo médico produce determinados incidentes adversos cuando no es así”, respondió la Cofepris a las solicitudes de información. La dependencia no atendió a repetidas solicitudes de entrevista hechas en el último mes.
Silvia Álvarez tenía 25 años y estudiaba Arquitectura en la UAM cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. En 1997 le instalaron el primero de tres marcapasos. Foto: Nadia Baram[/caption]
Apenas tenía 25 años, estudiaba Arquitectura en la Universidad Autónoma Metropolitana, cuando le diagnosticaron un bloqueo que impedía que su corazón bombeara suficiente sangre al cuerpo. El diagnóstico más improbable para una mujer que entrenaba con intensidad para competir en la liga nacional de atletismo.
La única alternativa que le dieron los médicos para poner fin a los recurrentes desmayos era implantarle un marcapasos que estimulara su corazón. La primera vez que entró a quirófano fue el 4 de junio de 1997, en el hospital Siglo XXI de la Ciudad de México.
El día que le instalaron el remedio, comenzó la verdadera pesadilla. Todo está plasmado en un expediente con cientos de páginas. “El marcapasos fue lo que me arruinó porque me la vivía en el hospital”, dijo una tarde de octubre sentada en el comedor de su casa de la colonia Roma, en la Ciudad de México. “Según la situación del marcapasos esa era mi vida. Es una vida robada”, dijo Álvarez, que hoy tiene 49 años y una hija de 19.
El de Silvia Álvarez no es cualquier expediente. “Disfunción de marcapasos” salta a la vista en un certificado médico tras otro. Las anotaciones se refieren a dos de los tres marcapasos que le han implantado en el pecho, el primero en 1997, otro más en 2006 y el último en 2008; el diagnóstico se repite en los reportes de las tres otras ocasiones que los médicos abrieron su pecho para reacomodar un cable que se había desprendido, o para reubicar el generador del marcapasos que se había desplazado de lugar. O la última vez que intentaron, sin éxito, remover los cables de un anterior dispositivo que ya se habían adherido firmemente al corazón, lo que explicaba algunos dolores.
“La paciente ha tenido varias cirugías desde que se implantó por primera vez su marcapasos, todas ellas por disfunción, una por desplazamiento del cable atrial, otras por problemas en la estimulación del marcapaso y otras por la posición del generador”, exhibe un resumen clínico del Hospital General Regional No. 1 de Tijuana, de agosto de 2008.
En suma, su expediente arroja una veintena de diagnósticos, de hospitales públicos y privados, y reportes que dan cuenta del deterioro progresivo de su salud: el dolor persistente, los mareos, los desvanecimientos, las fuertes punzadas en el hombro y en el pecho; la dificultad que llegó a tener para mover siquiera los brazos, además de palpitaciones, arritmias, taquicardias y la pérdida fugaz de la visión.
A la fecha, ningún médico le ha explicado qué ocurrió con sus marcapasos Prodigy, de Medtronic, o el Protos, de Biotronik: si sus males se debían a fallas de los dispositivos, como parecen indicar sus registros, o si su corazón rechazó el implante o los médicos fallaron en la instalación .
“Eso jamás me lo aclararon, en todas las notas aparece ‘disfunción’; nosotros preguntábamos a qué se debía y nos decían que un cable se movió y que el generador cambió de posición”. Y nada más.
Resulta difícil imaginar que un caso como el de Silvia pasara inadvertido después de una procesión de tantos años por tantos hospitales. En su expediente y en la recolección que ella y su esposo Julián Hernández Reyes tienen de ese tiempo, no hay registro de que se hubiera acercado algún ejecutivo de la empresa fabricante, o que alguno de sus médicos buscase respuestas con el fabricante.
Ya desde 1998 había una regulación en México que obligaba a la industria a reportar posibles efectos adversos de sus medicamentos e implantes. Pero fue hasta 2013 que la Comisión Nacional para la Protección Contra Riesgos Sanitarios (Cofepris) quedó a cargo de montar un sistema de vigilancia para recibir y atender los reportes de dispositivos médicos.
Una nueva normativa ordenó que se estableciera en México un sistema similar al que funcionaba, hacía dos décadas, para detectar y prevenir las reacciones adversas a los medicamentos, y que depende de un sistema de reporte de efectos adversos que alimentan pacientes, médicos, hospitales y la industria.
Ese sistema hoy día hace posible que lleguen cada año decenas de alertas a médicos y hospitales alrededor del país. Les llevan novedades acerca del uso de ciertos fármacos, los riesgos o interacciones con otros medicamentos, y en ocasiones anuncian el retiro de productos por problemas de seguridad.
Una investigación de Quinto Elemento Lab, Mexicanos Contra la Corrupción y la Impunidad y Proceso, desarrollada con decenas de entrevistas y cientos de solicitudes de información al gobierno federal y a dependencias en 32 estados, revela que este sistema ha fallado en velar por la seguridad de pacientes como Silvia Álvarez Vega.
Este reportaje es parte del proyecto que lideró el Consorcio Internacional de Periodistas de Investigación (ICIJ por sus siglas en inglés), en el cual trabajaron más de 250 periodistas de 58 medios en 36 países, y que ha puesto al descubierto que las autoridades sanitarias no han logrado proteger a millones de pacientes alrededor del mundo, que resultaron con lesiones provocadas por implantes que debían aliviarlos.
La información obtenida vía Transparencia para el caso de México y los testimonios de pacientes y médicos así lo confirmaron.
El Instituto Mexicano del Seguro Social realiza casi 1.5 millones de cirugías al año, y no ha reportado un solo incidente adverso de 2006 a la fecha, lapso de años de los que se solicitó la información. Lo mismo ocurre con el ISSSTE, otro de los mayores sistemas de salud en el país. Ninguno respondió a las solicitudes de entrevista.
En el Instituto Nacional de Cardiología, el responsable de vigilar fármacos desconocía hace unas semanas si alguien ahí da seguimiento al tema de dispositivos, y en el Instituto Nacional de Pediatría, apenas desde mediados de año tienen a personal para dar seguimiento a posibles reportes.
Según la Cofepris, de 2013 a la fecha han llegado a sus manos dos mil 254 reportes de incidentes adversos ocasionados por dispositivos en diversas regiones del país.
Una diferencia considerable, si se compara con los 5.4 millones de reportes que enviaron los fabricantes, médicos, abogados y pacientes en la última década, a la agencia del gobierno estadounidense a cargo de la vigilancia, la Food and Drug Administration (FDA), y que fueron analizados por ICIJ. Estos reportes a la FDA están relacionados con 1.7 millones de lesiones y 83 mil muertes de personas.
Lo que la investigación también encontró es que en EU hubo 26 mil 700 retiros de dispositivos en la última década y ocho mil 300 en Canadá. México, que es uno de los más grandes mercados de dispositivos en América Latina, sólo reportó dos y ambos productos eran de bajo riesgo. El primero fue una cánula –un delgado tubo que se introduce en una incisión en la piel del paciente para explorar sus articulaciones- y el otro fue un tubo de gel lubricante sexual.
La vigilancia de los dispositivos médicos es importante por tratarse de equipos que se implantan dentro del cuerpo y porque, según reveló la investigacIón internacional de ICIJ, los gobiernos imponen estándares de seguridad más bajos a los implantes médicos que a las medicinas. (https://goo.gl/r59vtW)
Es también pertinente por el gran empuje que tienen la industria y su brazo comercial. Solo en México hay casi 40,000 productos autorizados y la colección crece en 2,500 permisos por año.
Una industria crece
El gobierno considera a éste un sector estratégico. Las más grandes empresas del mundo tienen fábricas aquí, sobre todo en Tijuana y el corredor de la frontera norte; México ya aparece en el lugar ocho entre los exportadores de dispositivos más grandes en el mundo.
No solo eso. México es un importante mercado para sus productos -les dio ventas por nueve mil 568 mdd en 2017 y crecerá en los próximos años, indican análisis del mercado. Una gran porción de la población de México está entrando a la edad adulta; los mayores de 50 años están siempre entre los mejores clientes de este sector que desarrolla, fabrica y vende prótesis de columna para aliviar el dolor de personas con vértebras dañadas; stents que puestos en las arterias han salvado la vida a millones de personas con cardiopatías.
Sin embargo, según las fuentes consultadas, el gobierno federal ha puesto más atención en ayudar a la industria a crecer que en desarrollar un aparato robusto que vigile la seguridad de los dispositivos que están siendo utilizados.
Cofepris presumió hace unos meses que logró dar trámite a más de 19,000 solicitudes de permiso en un tiempo récord de tres a 15 días, cuando es algo que suele resolver en meses.
En contraste, la plataforma que abrió en internet para recibir reportes de los médicos y ciudadanos lleva casi un año caída; funciona con intermitencias desde el terremoto de 2017.
El área que da seguimiento a los dispositivos médicos tenía seis integrantes en 2013 -
tres ingenieros, una química y dos pasantes-. Para 2015, el equipo había sumado un integrante más, según Lorena Garza de Allende, primera encargada del departamento.
De acuerdo con las fuentes consultadas, este pequeño equipo de Cofepris tiene a su cargo una tarea descomunal. Deben revisar el informe que cada cinco años entregan las empresas para renovar su permiso, y que contiene información sobre los incidentes adversos que se suscitaron y las medidas de seguridad que tomó, dijo Garza, actual vicepresidenta del Colegio de Ingenieros Biomédicos de México.
Los técnicos deben entrenar a médicos alrededor del país para que aprendan a identificar y a reportar un posible incidente adverso y dar a conocer entre pacientes que, también ellos, tienen derecho a reportar y cómo hacerlo. Además les toca atender los reportes de incidentes adversos y asegurarse que la industria investigue. Porque, según la norma mexicana que regula a los dispositivos, son las empresas las que deben investigar.
A contrapelo de la política de la FDA y de otras agencias alrededor del mundo, que hacen pública la información de los reportes y la hacen circular al público, a la comunidad médica y la industria, la Cofepris mantiene la información reservada.
Según datos oficiales, en los últimos cinco años, la industria investigó 55 casos de incidentes graves en pacientes en México, pero la Cofepris negó revelar los detalles. Reservó el nombre del dispositivo, la marca y el modelo y los daños que provocó. Esa es información que sí publican los órganos de vigilancia de otros países.
“En caso de que se diera a conocer la información contenida en los expedientes de tecnovigilancia, la población podría suponer que un determinado dispositivo médico produce determinados incidentes adversos cuando no es así”, respondió la Cofepris a las solicitudes de información. La dependencia no atendió a repetidas solicitudes de entrevista hechas en el último mes.
 Sin cultura del reporte
Una tarde de junio en un salón del WTC Ciudad de México, medio centenar de especialistas de la industria, funcionarios y médicos atendieron a un panel acerca de la regulación de dispositivos.
Afuera, en el área de la exposición, representantes de compañías de EU, China y Corea conducían a los visitantes hasta sus exhibidores, para mostrarles una colección de cánulas y vastas series de clavos, tornillos y placas para arreglar, seguramente, muy dolorosos problemas de huesos.
“No es sólo tener un registro y vender -creo que eso es lo que hacemos ahora-”, dijo al micrófono María Gracia Fuentes, gerente de Asuntos Regulatorios de la trasnacional GE Healthcare en el salón vecino a la expo. “El reto más grande es ver qué pasa después: tener bases de datos confiables de lo que está pasando en el mercado”, dijo a sus colegas.
Casi cada una de las demás intervenciones de la tarde tocaron, aunque fuera de filón, el tema de la falta de reportes de incidentes adversos y el seguimiento. “Necesitamos alentar una cultura del reporte, por mínimo que sea el efecto adverso”, dijo Octavio Cruz Martínez, quien desde hace ocho años es jefe de la oficina que atiende reportes de medicamentos y dispositivos en el Hospital HMG de Coyoacán, en la capital.
Desde su pequeña oficina, a un costado del área de Epidemiología del hospital, Cruz Martínez recordó las visitas frecuentes que hacía antes el personal de Cofepris para capacitar a los empleados del hospital para que pudieran recibir y reportar efectos adversos de fármacos. No ocurrió lo mismo cuando se volvió obligatorio vigilar a los dispositivos.
Hasta ahora, las fallas más recurrentes que han llegado a la oficina de Cruz Martínez tienen que ver con tiras reactivas de glucómetros, medios de contraste, equipos para medir la presión, catéteres y mascarillas.
El reporte más grave se refiere a un incidente que ocurrió durante una cirugía, hace cinco años, cuando falló una engrapadora. En aquella ocasión notificaron el evento a Cofepris y al proveedor, pero nunca tuvieron respuesta. El hospital optó por desechar el producto sobrante y suspender la compra de esa marca.
Según Cruz, cuando se trata de medicamentos, la reacción de las empresas farmacéuticas suele ser diligente, visitan el hospital, lo que no sucede con los proveedores de dispositivos.
“El fabricante de dispositivos saca un producto al mercado y lo abandona (…) no le importa tanto qué está pasando con su producto, hasta que no ve que ya los van a retirar porque causaron varios eventos significativamente importantes”, dijo.
Sin cultura del reporte
Una tarde de junio en un salón del WTC Ciudad de México, medio centenar de especialistas de la industria, funcionarios y médicos atendieron a un panel acerca de la regulación de dispositivos.
Afuera, en el área de la exposición, representantes de compañías de EU, China y Corea conducían a los visitantes hasta sus exhibidores, para mostrarles una colección de cánulas y vastas series de clavos, tornillos y placas para arreglar, seguramente, muy dolorosos problemas de huesos.
“No es sólo tener un registro y vender -creo que eso es lo que hacemos ahora-”, dijo al micrófono María Gracia Fuentes, gerente de Asuntos Regulatorios de la trasnacional GE Healthcare en el salón vecino a la expo. “El reto más grande es ver qué pasa después: tener bases de datos confiables de lo que está pasando en el mercado”, dijo a sus colegas.
Casi cada una de las demás intervenciones de la tarde tocaron, aunque fuera de filón, el tema de la falta de reportes de incidentes adversos y el seguimiento. “Necesitamos alentar una cultura del reporte, por mínimo que sea el efecto adverso”, dijo Octavio Cruz Martínez, quien desde hace ocho años es jefe de la oficina que atiende reportes de medicamentos y dispositivos en el Hospital HMG de Coyoacán, en la capital.
Desde su pequeña oficina, a un costado del área de Epidemiología del hospital, Cruz Martínez recordó las visitas frecuentes que hacía antes el personal de Cofepris para capacitar a los empleados del hospital para que pudieran recibir y reportar efectos adversos de fármacos. No ocurrió lo mismo cuando se volvió obligatorio vigilar a los dispositivos.
Hasta ahora, las fallas más recurrentes que han llegado a la oficina de Cruz Martínez tienen que ver con tiras reactivas de glucómetros, medios de contraste, equipos para medir la presión, catéteres y mascarillas.
El reporte más grave se refiere a un incidente que ocurrió durante una cirugía, hace cinco años, cuando falló una engrapadora. En aquella ocasión notificaron el evento a Cofepris y al proveedor, pero nunca tuvieron respuesta. El hospital optó por desechar el producto sobrante y suspender la compra de esa marca.
Según Cruz, cuando se trata de medicamentos, la reacción de las empresas farmacéuticas suele ser diligente, visitan el hospital, lo que no sucede con los proveedores de dispositivos.
“El fabricante de dispositivos saca un producto al mercado y lo abandona (…) no le importa tanto qué está pasando con su producto, hasta que no ve que ya los van a retirar porque causaron varios eventos significativamente importantes”, dijo.
 Una alerta que llegó tarde
En agosto de 2011, un año después de que un médico diagnosticó a su hijo de nueve años con diabetes tipo 1, la aseguradora del ingeniero Víctor Aarón Vázquez Gandarilla y su esposa les autorizó la compra de una bomba de insulina Paradigm, fabricada por la compañía trasnacional Medtronic. Este dispositivo suple la función del páncreas al liberar insulina de manera continua.
Les ilusionó pensar que ese aparato iba a darle más libertades a su hijo. Podría correr otra vez y comer como los demás niños en la Primaria, dormir tranquilo y despreocuparse de la rutina de inyectarse cuatro veces en el día.
El vendedor solo les hizo dos advertencias. Ninguna de ellas les hizo pensar que la bomba podría poner en riesgo la vida del pequeño.
Una llamada de la escuela los puso sobre aviso en 2012. El niño tenía un fuerte dolor de estómago y niveles de glucosa como nunca los había tenido. Los Vázquez lo llevaron a toda prisa al hospital Ángeles de Chihuahua. El pequeño cayó en un episodio de cetoacidosis severa, dijo Víctor Vázquez. Sus células dejaron de recibir la glucosa que necesitan como fuente de energía. El niño estuvo muy cerca de caer en un coma diabético.
Los médicos no explicaron qué disparó esta crisis y una vez fuera del hospital, días más tarde, los Vázquez decidieron volver a la coreografía de las inyecciones diarias. El vendedor del aparato no devolvió sus llamadas y decidieron abandonar el uso del dispositivo.
Ocho meses más tarde llegó la explicación que había faltado, en un mail con una alerta de seguridad a clientes de la bomba de insulina Paradigm. La compañía Medtronic les avisaba del riesgo posible de que la bomba pudiera administrar una cantidad excesiva o insuficiente de insulina.
La explicación que no les dieron los médicos, había llegado al fin.
Víctor Vázquez escribió a la empresa en México y a otras 16 direcciones en Estados Unidos. El área Legal de Medtronic para México y Centroamérica le respondió vía correo electrónico. Querían revisar el equipo. “Medtronic está dispuesta a compartir los protocolos de exámenes y pruebas propuestas con usted, si usted se compromete a mantener cualquier tipo de información del protocolo como confidencial”, ofrecieron a cambio.
La familia Vázquez no aceptó esa condición y, asesorados por una abogada, pidieron una indemnización que Medtronic declinó, según respondió la encargada de Asuntos Legales en septiembre de 2013.
Aunque ese mismo año entró en vigor la norma de tecnovigilancia, Víctor Vázquez nunca presentó un reporte de incidente adverso a Cofepris. No sabía que podía hacerlo.
En lugar de eso, Víctor Vázquez creó un grupo de Facebook para advertir a los padres de otros niños sobre los potenciales riesgos asociados a la bomba. Ahí publica las noticias y alertas que emiten los gobiernos de otros países.
Un análisis del ICIJ a la base de datos de la FDA revela que, en el último decenio, las bombas de insulina de Medtronic estarían relacionadas con más de mil 800 muertes y cerca de 96 mil lesiones a pacientes, cifras que superan a cualquier otro dispositivo médico. En México, la Cofepris sólo registra cuatro incidentes adversos.
Información bajo reserva
El sistema de vigilancia de la Cofepris es presentado como un modelo que toma lo mejor de las agencias internacionales y de la experiencia mexicana en el seguimiento a medicinas.
Pero a diferencia de otras agencias en el mundo, Cofepris no comunica al público o a la comunidad médica el detalle de lo que ocurre con los implantes.
La base de datos de incidentes de la FDA es pública, aún cuando falta investigar estos reportes; no son evidencia todavía de que los dispositivos hayan causado las lesiones o muertes.
Cofepris respondió a una solicitud de información proporcionando la base de datos de incidentes adversos, con información tachada: debajo de placas negras quedaron el nombre del fabricante, la marca del dispositivo y, en ocasiones, la descripción del incidente y del daño que presumiblemente causó.
Los directivos de las asociaciones nacionales de Cardiología, Ginecología, Obesidad y Diabetes, dijeron en entrevista que Cofepris nunca les ha compartido información sobre alertas, o avisos de seguridad y riesgos con implantes y equipos.
Según sus propios registros, Cofepris solo ha emitido tres alertas. Las tres avisaban al público de productos a la venta que no tenían autorización, entre ellas una copa menstrual, pruebas de detección de VIH y una serie de tornillos, placas y prótesis, sin permiso, que decomisó en las instalaciones de una empresa.
“Cofepris nunca ha emitido un listado, como lo hace en los fármacos, en el que diga que en este año, 2018, han tenido esta lista de dispositivos que ya están retirados, o no se recomienda su uso por el riesgo”, dijo Octavio Cruz, del Hospital HMG. En contraste, a su computadora llegan hasta 20 alertas de Cofepris relacionadas con medicamentos, cada año.
Desde el piso 38 en el WTC donde están las oficinas del Colegio Mexicano de Especialistas en Ginecología y Obstetricia, su presidente Eduardo Sirahuén Neri cuenta que, ante la falta de información oficial, los médicos suelen echar mano de la información de la FDA y agencias europeas para mantenerse al tanto.
Fue en las alertas de la FDA, por ejemplo, que supo del retiro de algunas mallas que han servido para evitar la caída de órganos vaginales.
Una alerta que llegó tarde
En agosto de 2011, un año después de que un médico diagnosticó a su hijo de nueve años con diabetes tipo 1, la aseguradora del ingeniero Víctor Aarón Vázquez Gandarilla y su esposa les autorizó la compra de una bomba de insulina Paradigm, fabricada por la compañía trasnacional Medtronic. Este dispositivo suple la función del páncreas al liberar insulina de manera continua.
Les ilusionó pensar que ese aparato iba a darle más libertades a su hijo. Podría correr otra vez y comer como los demás niños en la Primaria, dormir tranquilo y despreocuparse de la rutina de inyectarse cuatro veces en el día.
El vendedor solo les hizo dos advertencias. Ninguna de ellas les hizo pensar que la bomba podría poner en riesgo la vida del pequeño.
Una llamada de la escuela los puso sobre aviso en 2012. El niño tenía un fuerte dolor de estómago y niveles de glucosa como nunca los había tenido. Los Vázquez lo llevaron a toda prisa al hospital Ángeles de Chihuahua. El pequeño cayó en un episodio de cetoacidosis severa, dijo Víctor Vázquez. Sus células dejaron de recibir la glucosa que necesitan como fuente de energía. El niño estuvo muy cerca de caer en un coma diabético.
Los médicos no explicaron qué disparó esta crisis y una vez fuera del hospital, días más tarde, los Vázquez decidieron volver a la coreografía de las inyecciones diarias. El vendedor del aparato no devolvió sus llamadas y decidieron abandonar el uso del dispositivo.
Ocho meses más tarde llegó la explicación que había faltado, en un mail con una alerta de seguridad a clientes de la bomba de insulina Paradigm. La compañía Medtronic les avisaba del riesgo posible de que la bomba pudiera administrar una cantidad excesiva o insuficiente de insulina.
La explicación que no les dieron los médicos, había llegado al fin.
Víctor Vázquez escribió a la empresa en México y a otras 16 direcciones en Estados Unidos. El área Legal de Medtronic para México y Centroamérica le respondió vía correo electrónico. Querían revisar el equipo. “Medtronic está dispuesta a compartir los protocolos de exámenes y pruebas propuestas con usted, si usted se compromete a mantener cualquier tipo de información del protocolo como confidencial”, ofrecieron a cambio.
La familia Vázquez no aceptó esa condición y, asesorados por una abogada, pidieron una indemnización que Medtronic declinó, según respondió la encargada de Asuntos Legales en septiembre de 2013.
Aunque ese mismo año entró en vigor la norma de tecnovigilancia, Víctor Vázquez nunca presentó un reporte de incidente adverso a Cofepris. No sabía que podía hacerlo.
En lugar de eso, Víctor Vázquez creó un grupo de Facebook para advertir a los padres de otros niños sobre los potenciales riesgos asociados a la bomba. Ahí publica las noticias y alertas que emiten los gobiernos de otros países.
Un análisis del ICIJ a la base de datos de la FDA revela que, en el último decenio, las bombas de insulina de Medtronic estarían relacionadas con más de mil 800 muertes y cerca de 96 mil lesiones a pacientes, cifras que superan a cualquier otro dispositivo médico. En México, la Cofepris sólo registra cuatro incidentes adversos.
Información bajo reserva
El sistema de vigilancia de la Cofepris es presentado como un modelo que toma lo mejor de las agencias internacionales y de la experiencia mexicana en el seguimiento a medicinas.
Pero a diferencia de otras agencias en el mundo, Cofepris no comunica al público o a la comunidad médica el detalle de lo que ocurre con los implantes.
La base de datos de incidentes de la FDA es pública, aún cuando falta investigar estos reportes; no son evidencia todavía de que los dispositivos hayan causado las lesiones o muertes.
Cofepris respondió a una solicitud de información proporcionando la base de datos de incidentes adversos, con información tachada: debajo de placas negras quedaron el nombre del fabricante, la marca del dispositivo y, en ocasiones, la descripción del incidente y del daño que presumiblemente causó.
Los directivos de las asociaciones nacionales de Cardiología, Ginecología, Obesidad y Diabetes, dijeron en entrevista que Cofepris nunca les ha compartido información sobre alertas, o avisos de seguridad y riesgos con implantes y equipos.
Según sus propios registros, Cofepris solo ha emitido tres alertas. Las tres avisaban al público de productos a la venta que no tenían autorización, entre ellas una copa menstrual, pruebas de detección de VIH y una serie de tornillos, placas y prótesis, sin permiso, que decomisó en las instalaciones de una empresa.
“Cofepris nunca ha emitido un listado, como lo hace en los fármacos, en el que diga que en este año, 2018, han tenido esta lista de dispositivos que ya están retirados, o no se recomienda su uso por el riesgo”, dijo Octavio Cruz, del Hospital HMG. En contraste, a su computadora llegan hasta 20 alertas de Cofepris relacionadas con medicamentos, cada año.
Desde el piso 38 en el WTC donde están las oficinas del Colegio Mexicano de Especialistas en Ginecología y Obstetricia, su presidente Eduardo Sirahuén Neri cuenta que, ante la falta de información oficial, los médicos suelen echar mano de la información de la FDA y agencias europeas para mantenerse al tanto.
Fue en las alertas de la FDA, por ejemplo, que supo del retiro de algunas mallas que han servido para evitar la caída de órganos vaginales.
 Salud en riesgo
María de la Luz Vanegas García, una abogada de 39 años de la Ciudad de México, encontró más información en redes sociales de la que logró de sus médicos.
Fue a finales de 2012 cuando le implantaron un anticonceptivo que se llama Essure, del laboratorio Bayer y que consiste en un par de resortes de metal que se insertan en las trompas de Falopio.
Luz Vanegas asegura que los dolores de cabeza y abdomen, la fatiga y los piquetes en el vientre comenzaron poco tiempo después de la operación y no la han abandonado en seis años.
Vanegas ha visto varios especialistas y de ninguno de ellos escuchó la información que, en cambio, encontró en grupos cerrados de Facebook en el que participan mujeres de diversos países, que viven con el dispositivo. Este año, un documental en Netflix le acabó de abrir los ojos. Se enteró que los resortes del Essure pueden encarnarse en las trompas de Falopio y que en ocasiones es necesario extirpar las trompas o el útero completo, para remover el dispositivo.
De acuerdo con documentos del gobierno de EU, la FDA recibió 26 mil 773 reportes de incidentes relacionados con este producto, entre 2002 y 2017.
Aunque la agencia estadounidense sostiene que los beneficios del Essure superan los riesgos, en los últimos años dispuso una serie de medidas para que las clientas estén informadas de las implicaciones que puede traer su uso.
Fernando Contreras, director de Gynecon, la empresa que fue autorizada a comercializar el Essure en México, estima que cerca de 900 mujeres en México se instalaron este anticonceptivo en los años que estuvo a la venta aquí, y no ha sabido que hubiera problemas.
Aunque en México no hay reportes de incidentes adversos, Contreras recuerda que Bayer le hacía llegar notificaciones de otros países. “Al principio los revisaba”, dijo, “pero cuando me di cuenta que eran de Inglaterra, de Francia, pues tengo mucho trabajo como para estar revisando todos los que no tienen que ver con nosotros.... Los que yo alcancé a leer los catalogaban como no graves, porque después ya ni los leía”.
El sistema de reportes es, en todos los países, la piedra angular del sistema de vigilancia.
En México se reporta poco, y a menudo se reporta mal. “Uno de los posibles problemas en los sistemas de detección y cuantificación de incidentes adversos es la falta de calidad en la información proporcionada en las notificaciones de incidentes adversos” argumentó Cofepris a una solicitud de información.
Quinto Elemento Lab, MCCI y Proceso recibieron 564 reportes de incidentes adversos que enviaron a Cofepris una serie de dependencias de salud en 16 estados y cuatro hospitales e institutos de especialidad.
La mayoría reportó defectos de calidad en productos de menor riesgo que un implante, como guantes rotos, telas adhesivas que irritaban la piel y tijeras sin filo, además de inconvenientes con medios de contraste, glucómetros, vendas y pinzas.
Sólo una tercera parte de los reportes tiene información suficiente para identificar plenamente el producto y solo uno de cada cinco reportes incluye el nombre del fabricante o distribuidor.
Remedios para el dolor
Silvia Álvarez Vega hace mucho tiempo perdió la cuenta del número de veces que ingresó a salas de Urgencias por complicaciones derivadas del primero y segundo marcapasos.
Ella estaba a unos meses de casarse con Julián cuando le pusieron el primer dispositivo. Su hija Elisa apenas tenía un año cuando Silvia salió de una cirugía en la que intentaron reacomodarle un cable; Silvia pudo cargar a su hija muy poco en sus primeros años de vida.
En el comedor de su departamento, en la Roma Norte, están guardadas en cajas de cartón miles de hojas con los estudios y diagnósticos de especialistas y la papelería que presentó a docenas de instituciones, buscando que alguna tomara su caso. Lo que no ha ocurrido aún.
Ese desamparo, dice Silvia, le causó un dolor profundo. “El sentirme ignorada, condenada a llevar una vida a medias o menos que medias”, dijo.
Por eso comenzó a pintar. Los más grandes cuadros que descansan en el piso y las paredes de su pequeño estudio, retratan la impotencia y el dolor de esos días.
La pintura fue el recurso que ella encontró para hacer frente y procesar ese desasosiego que aún persiste. La batería del generador de su tercer marcapaso está por agotarse y será necesario que vuelvan a operarla a fines de este año, y hacer el reemplazo. Silvia Álvarez se aferra a seguir luchando. “Merezco una oportunidad por todo el daño que me hicieron”.
Salud en riesgo
María de la Luz Vanegas García, una abogada de 39 años de la Ciudad de México, encontró más información en redes sociales de la que logró de sus médicos.
Fue a finales de 2012 cuando le implantaron un anticonceptivo que se llama Essure, del laboratorio Bayer y que consiste en un par de resortes de metal que se insertan en las trompas de Falopio.
Luz Vanegas asegura que los dolores de cabeza y abdomen, la fatiga y los piquetes en el vientre comenzaron poco tiempo después de la operación y no la han abandonado en seis años.
Vanegas ha visto varios especialistas y de ninguno de ellos escuchó la información que, en cambio, encontró en grupos cerrados de Facebook en el que participan mujeres de diversos países, que viven con el dispositivo. Este año, un documental en Netflix le acabó de abrir los ojos. Se enteró que los resortes del Essure pueden encarnarse en las trompas de Falopio y que en ocasiones es necesario extirpar las trompas o el útero completo, para remover el dispositivo.
De acuerdo con documentos del gobierno de EU, la FDA recibió 26 mil 773 reportes de incidentes relacionados con este producto, entre 2002 y 2017.
Aunque la agencia estadounidense sostiene que los beneficios del Essure superan los riesgos, en los últimos años dispuso una serie de medidas para que las clientas estén informadas de las implicaciones que puede traer su uso.
Fernando Contreras, director de Gynecon, la empresa que fue autorizada a comercializar el Essure en México, estima que cerca de 900 mujeres en México se instalaron este anticonceptivo en los años que estuvo a la venta aquí, y no ha sabido que hubiera problemas.
Aunque en México no hay reportes de incidentes adversos, Contreras recuerda que Bayer le hacía llegar notificaciones de otros países. “Al principio los revisaba”, dijo, “pero cuando me di cuenta que eran de Inglaterra, de Francia, pues tengo mucho trabajo como para estar revisando todos los que no tienen que ver con nosotros.... Los que yo alcancé a leer los catalogaban como no graves, porque después ya ni los leía”.
El sistema de reportes es, en todos los países, la piedra angular del sistema de vigilancia.
En México se reporta poco, y a menudo se reporta mal. “Uno de los posibles problemas en los sistemas de detección y cuantificación de incidentes adversos es la falta de calidad en la información proporcionada en las notificaciones de incidentes adversos” argumentó Cofepris a una solicitud de información.
Quinto Elemento Lab, MCCI y Proceso recibieron 564 reportes de incidentes adversos que enviaron a Cofepris una serie de dependencias de salud en 16 estados y cuatro hospitales e institutos de especialidad.
La mayoría reportó defectos de calidad en productos de menor riesgo que un implante, como guantes rotos, telas adhesivas que irritaban la piel y tijeras sin filo, además de inconvenientes con medios de contraste, glucómetros, vendas y pinzas.
Sólo una tercera parte de los reportes tiene información suficiente para identificar plenamente el producto y solo uno de cada cinco reportes incluye el nombre del fabricante o distribuidor.
Remedios para el dolor
Silvia Álvarez Vega hace mucho tiempo perdió la cuenta del número de veces que ingresó a salas de Urgencias por complicaciones derivadas del primero y segundo marcapasos.
Ella estaba a unos meses de casarse con Julián cuando le pusieron el primer dispositivo. Su hija Elisa apenas tenía un año cuando Silvia salió de una cirugía en la que intentaron reacomodarle un cable; Silvia pudo cargar a su hija muy poco en sus primeros años de vida.
En el comedor de su departamento, en la Roma Norte, están guardadas en cajas de cartón miles de hojas con los estudios y diagnósticos de especialistas y la papelería que presentó a docenas de instituciones, buscando que alguna tomara su caso. Lo que no ha ocurrido aún.
Ese desamparo, dice Silvia, le causó un dolor profundo. “El sentirme ignorada, condenada a llevar una vida a medias o menos que medias”, dijo.
Por eso comenzó a pintar. Los más grandes cuadros que descansan en el piso y las paredes de su pequeño estudio, retratan la impotencia y el dolor de esos días.
La pintura fue el recurso que ella encontró para hacer frente y procesar ese desasosiego que aún persiste. La batería del generador de su tercer marcapaso está por agotarse y será necesario que vuelvan a operarla a fines de este año, y hacer el reemplazo. Silvia Álvarez se aferra a seguir luchando. “Merezco una oportunidad por todo el daño que me hicieron”.